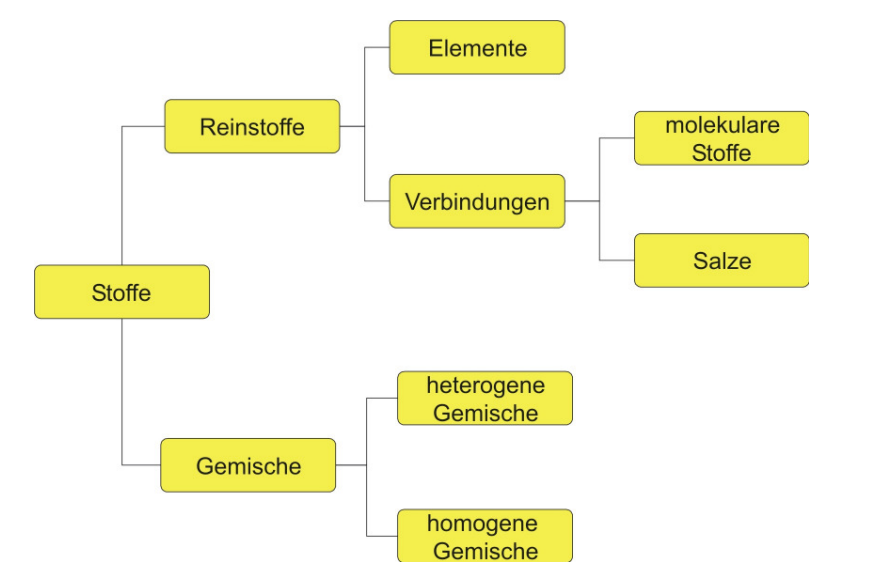
Stoffe
1.1 Reinstoffe
Reinstoffe können durch physikalische Trennverfahren (z.B.: Filtrieren, Destillieren) nicht zerlegt werden. Sie besitzen charakteristische Eigenschaften (z.B.: Siedepunkt, Schmelzpunkt, Dichte, Härte, elektrische Leitfähigkeit). Die Baustoffe von Reinstoffen sind Atome, Moleküle oder Ionen.
1.1.1 Elemente
Stoffebene: Elemente sind Reinstoffe, die sich durch eine chemische Reaktion nicht zersetzen lassen.
Teilchenebene: Elemente besitzen nur eine Sorte von Atomen.
Besonderheit: Es gibt Atomsorten, die elementar in der Natur immer als zweiatomige Moleküle auftreten: H2, O2, N2, Cl2, Br2, I2, F2
1.1.2 Verbindungen
Stoffebene: Verbindungen sind ebenfalls Reinstoffe, die man durch eine Analyse in mehrere Stoffe zerlegen kann, und durch eine Synthese aus den Elementen
aufgebaut werden können.
Teilchenebene: Verbindungen sind ein Verband aus Teilchen (Atomen oder Ionen) unterschiedlicher Art. Wir unterscheiden zwischen Molekülen und Salzen.
1.1.2.1 Moleküle
Ein Molekül ist ein Teilchen, das aus mindestens zwei Nichtmetallatomen (die gleich oder verschieden sein können) aufgebaut ist. z.B. 1 Wassermolekül: H2O.
1.1.2.2 Salze
Verbindungen zwischen Metall- und Nichtmetallionen. z.B. Kochsalz: NaCl.
1.1.2.3 Formeln chemischer Verbindungen
Jedes chemische Element, d.h. jede Atomart, wird durch ein Elementsymbol beschrieben (z.B.: Eisen Fe). Alle Elemente sind im vollständigen Periodensystem
der Elemente (PSE) aufgelistet. Die Anzahl der Atome bzw. Ionen eines Elements in einer Verbindung wird dem jeweiligen Elementsymbol in der Formel als tiefgestellte Zahl (Index) nachgestellt z.B.: CO2 Kohlenstoffdioxid). Der Index „1“ wird nicht angegeben.
1.1.2.3.1 Aufstellen einer Formel (Suchen nach den richtigen Indices)
- Man stellt die chemische Formel so auf, dass die Elementsymbole, Bsp.: N O die im PSE weiter links stehen, in der Formel zuerst geschrieben werden. Ausnahme: Wasserstoff = H.
- Anschließend werden die Wertigkeiten (die Wertigkeit III II der Elemente im gekürzten PSE nimmt mit der Hauptgruppen- N2 O3 nummer bis zur IV. Hauptgruppe zu und nimmt dann bis zur VIII. Hauptgruppe ab (also I, II, III, IV, III, II, I, 0) hinzugefügt und Anschließend die „Über-Kreuz-Regel“ angewandt => man erhält die Indices.
1.1.2.3.2 Benennung von Verbindungen aus zwei Atomsorten
- Die Indices werden wie folgt übersetzt: „di“ und „tri“
1: mono 5: penta
2: di 6: hexa
3: tri 7: hepta
4: tetra 8: octa
Vom erstgenannten Element verwendet man den deutschen N: Stickstoff Namen und vom zweiten dessen Stammnamen:
- O: Oxid
- O: Oxid
- S: Sulfid
- Cl: Chlorid
- N: Nitrid
- C: Carbid
- Br: Bromid
- H: Hydrid
- F: Fluorid
- I: Iodid
Nun wird der Name wie folgt aufgebaut: Distickstofftrioxid griech. Zahlwort – deutscher Name des 1. Elements griech. Zahlwort – Stammnamen des 2. Elements
1.2 Gemische
Stoffgemische bestehen aus zwei oder mehreren Reinstoffen. Man unterscheidet einheitlich aussehende homogene Stoffgemische (Bsp.: Lösung, Legierung) von
uneinheitlich aussehenden heterogenen Stoffgemischen (Bsp.: Suspension, Rauch), bei denen man die einzelnen Komponenten mit dem bloßen Auge leicht
unterscheiden kann.
2 Teilchenmodell
Das Teilchenmodell beschreibt, dass alle Stoffe aus kleinsten, kugelförmigen Teilchen bestehen. Die Teilchen eines Stoffes sind gleich groß und besitzen die gleiche Masse
3 Reaktionen
3.1 Kennzeichen einer chemischen Reaktion
- Stoffumwandlung: aus den Ausgangsstoffen (Edukten) entstehen neue Stoffe (Produkte) mit anderen Stoffeigenschaften.
- Energiebeteiligung: man unterscheidet hierbei zwischen exothermen und endothermen Reaktionen
3.2 Reaktionstypen nach Art der Stoffumwandlung
3.2.1 Analyse
Ein Edukt wird in mehrere Produkte zerlegt: A → B + (C + D…)
3.2.2 Synthese
Mehrere Edukte reagieren zu einem Produkt: A + B + (C + D…) → Z
3.2.3 kompliziertere Umsetzungen
Mehrere Edukte reagieren zu mehreren Produkten.
3.2.4 Oxidation (Verbrennung)
Eine Reaktion, bei der sich ein Stoff mit Sauerstoff verbindet; es entstehen dabei Oxide.
3.3 Reaktionstypen nach Art der Energiebeteiligung
3.3.1 Exotherme Reaktion
Nach dem Erreichen der Aktivierungsenergie (die zum Auslösen einer chemischen Reaktion benötigte Energie kann zum Beispiel in Form von Wärme, Licht,
elektrischer Energie oder mechanischer Energie zugeführt werden) läuft die Reaktion vollständig bis zum Ende ab. Es wird dabei Energie frei. Bsp.: Abbrennen einer Wunderkerze.
3.3.2 Endotherme Reaktion
Es muss ständig Energie zugeführt werden (Aktivierungsenergie) damit die Reaktion abläuft. Bsp.: einen Sonnenbrand bekommen.
3.3.3 Katalysator
Ein Katalysator ist ein Stoff, der die Aktivierungsenergie einer chemischen Reaktion herabsetzt. Dadurch wird die Reaktion beschleunigt. Der Katalysator liegt nach der Reaktion unverändert vor.
3.4 Sinnvolle Gliederung von Experimenten
V: Versuchsbeschreibung (Was wird gemacht? Oft ist eine Skizze hilfreich)
B: Beobachtung (Was ist mit den Sinnen bzw. mit bestimmten Messgeräten wahrnehmbar/messbar?)
E: Erklärung (Warum treten die gemachten Beobachtungen auf?)
3.5 Wichtige Nachweisreaktionen
3.5.1 Sauerstoff: Glimmspanprobe
V: Ein glimmender Holzspan wird in die Stoffprobe eingeführt.
B: Der Span glimmt stärker auf bzw. entflammt.
3.5.2 Wasserstoff: Knallgasprobe
V: Man leitet die Stoffprobe in ein Reagenzglas und nährt sich mit diesem einer Flamme (Reagenzglas umdrehen!).
B: Knall.
3.5.3 Wasser
V: Man hält einen WATESMO-Wassersteststreifen mit einer Pinzette in die Stoffprobe.
B: Blaufärbung
3.5.4 Kohlenstoffdioxid: Kalkwasserprobe
V: Die Stoffprobe wird in Kalkwasser eingeführt.
B: Weiße Trübung.
3.5.5 pH-Wert einer Lösung mit Universalindikator (UI)
V: Wenige Tropfen UI werden in die Stoffprobe gegeben.
B: Rot-Orangefärbung: 0<pH<7
Gelbfärbung: pH = 7
Blau-Grünfärbung: 7<pH<14
3.6 Reaktionsgleichung
Bei einer chemischen Reaktion gruppieren sich die Atome bzw. Ionen um. Die Atome bzw. Ionen im Produkt haben also andere Bindungspartner als im Edukt.
Man unterscheidet zwischen einer Wortgleichung z.B.: Wasserstoff + Sauerstoff → Wasser und einer Formelgleichung
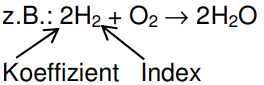
Man sagt: „Zwei Moleküle Wasserstoff reagieren mit einem Molekül Sauerstoff zu zwei Molekülen Wasser.“
4 Atombau und Periodensystem
4.1 Atomkern und Atomhülle
Ein Atom besteht aus einem Atomkern und der Atomhülle. Der Atomkern setzt sich aus positiv geladene Protonen und ungeladene Neutronen zusammen. Die Protonenzahl entspricht der Kernladungszahl (= Ordnungszahl). Sie charakterisiert die Atome eines Elements.
Die Atomhülle wird von elektrisch negativ geladenen Elektronen gebildet. Die Elektronen umkreisen den Atomkern gesetzmäßig auf Umlaufbahnen, den
sogenannten Elektronenschalen. Die Verteilung der Elektronen eines Atoms bzw. Ions auf die einzelnen Schalen bezeichnet man als Elektronenkonfiguration.
Zur Elektronenverteilung:
- Ermittle zunächst die Gesamtzahl an Elektronen mit Hilfe des PSE.
- Die Elektronen werden immer von innen nach außen auf die entsprechenden Schalen verteilt.
- Dabei ist zu beachten, dass die n-te Schale mit maximal 2·n2 Elektronen besetzt werden kann.
4.2 Periodensystem der Elemente (PSE)
Elemente werden nach steigender Ordnungszahl so angeordnet, dass Elemente mit ähnlichen Eigenschaften untereinander stehen.
Hauptgruppen: senkrechte Spalten -> Anzahl der Außenelektronen
Perioden: waagrechte Reihen -> Anzahl der Schalen
4.3 Zusammenhang: Atombau und PSE

4.4 Valenzelektronen (Außenelektronen)
Die Valenzelektronen sind die äußersten und für chemische Reaktionen wichtigsten Elektronen. Im PSE sind Elemente mit gleicher Anzahl an Valenzelektronen zu Hauptgruppen zusammengefasst. Edelgase sind inert, d.h. sie reagieren kaum mit anderen Elementen, da sie ein stabiles Elektronenoktett (Ausnahme: Helium) haben.
Valenzschreibweise:
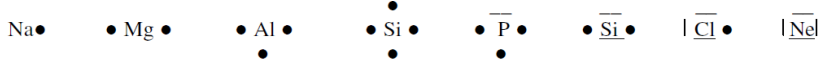
4.5 Oktettregel
Atome streben in chemischen Reaktionen eine stabile Edelgaskonfiguration an. Außer für Elemente der 1. Periode sind dies 8 Valenzelektronen.
5 Elektronenpaarbindung (Atombindung)
Durch Ausbildung einer Elektronenpaarbindung (= Atombindung) zwischen zwei Nichtmetall-Atomen entstehen Moleküle. Für eine einfache Elektronenpaarbindung stellt jedes Atom ein Elektron zur Verfügung. Das Bindungselektronenpaar wird beiden darüber verbundenen Atomen des Moleküls zugeordnet.
Bsp.: Wasserstoffbromid HBr

Durch die Ausbildung von Atombindungen erreichen die Bindungspartner eine Edelgaskonfiguration. Daher gilt: Die Anzahl der für die Edelgaskonfiguration noch benötigten Elektronen ist gleich der Anzahl der bindenden Elektronen. Zieht man von der Anzahl der Valenzelektronen die Anzahl der bindenden
Elektronen ab, so bleibt die Anzahl der nichtbindenden Elekronen übrig.
Bsp.: Das Bromatom benötigt noch ein Elektron, um die stabile Edelgaskonfiguration zu erreichen. Es besitzt somit ein bindendes Elektron.
7 Valenzelektronen – 1 bindendes Elektronen = 6 freie Elektronen | =>3 freie Elektronenpaare
5.2 Polare Atombindung am Beispiel von Wasser
Im Wassermolekül zieht das Sauerstoffatom die gemeinsam bindenden Elektronenpaare stärker an. Das Sauerstoffatom erhält dadurch eine
negative Teilladung (δ-). An den beiden Wasserstoffatomen herrscht somit ein Elektronenmangel. Sie besitzen eine positive Teilladung (δ+). Besitzt ein Molekül einen positiven und einen negativen Ladungsschwerpunkt, so ist es ein Dipol. Vor allem das Wassermolekül ist ein sehr starker Dipol.
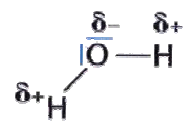
5.2.1 Wasserstoffbrückenbindungen
Die Teilladungen im Wasserstoffmolekül wirken sich auf die benachbarten Moleküle aus. Die positive Teilladung eines Sauerstoffatoms zieht die negative Ladung eines Wasserstoffatoms eines anderen Wassermoleküls an usw. Diese Art von zwischenmolekularer Bindung wird Wasserstoffbrückenbindungen genannt.
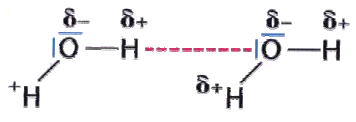
6 Salze
6.1 Ionen
Wir unterscheiden zwischen Kationen: positiv geladene Metallionen und Anionen:
negativ geladene Nichtmetallionen.
6.2 Ionenbindung
Metallatome geben zum Erreichen einer vollbesetzten äußeren Schale (Edelgaskonfiguration) Elektronen ab und werden zu Kationen.
(Kationen tragen keine eigene Endung. Bsp.: Mg2+ Magnesiumkation) Nichtmetallatome nehmen zur Erreichung der Edelgaskonfiguration Elektronen auf
und werden zu Anionen. (Anionen erhalten die Endung „-id“. Bsp.: Cl-Chloridanion)
6.3 Aufbau von Salzen
Sie sind aus Kationen und Anionen aufgebaut, die in einem Ionengitter regelmäßig angeordnet sind. Die Verhältnisformel eines Salzes gibt das Verhältnis Anzahl
Kationen: Anzahl Anionen wieder. Der Zusammenhalt erfolgt durch elektrostatische Anziehungskräftezwischen den entgegengesetzt geladenen Ionen. Salze sind insgesamt betrachtet stets elektrisch neutral.
7 Säuren und Laugen, Indikator
7.1 Säuren
Säuren sind Stoffe, die Protonen (H+-Ionen) abgeben können. Löst man beispielsweise eine wasserfreie Säure in Wasser, so spalten Säuremoleküle (HA)
Protonen (H+-Ionen) ab. Übrig bleiben Säurerestionen (A-):

Aus diesem Grund leiten sämtliche Säurelösungen den elektrischen Strom.
7.1.1 Wichtige Säuren
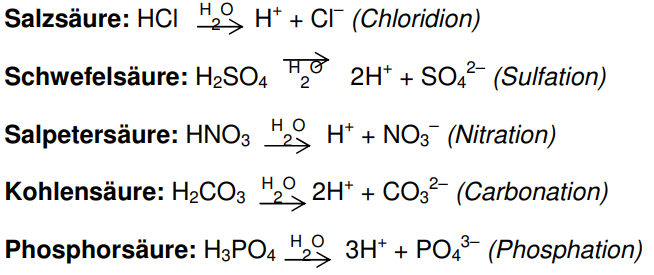
7.1.2 Reaktion von Säuren mit unedlen Metallen
Bei einer Reaktion einer Säurelösung mit unedlen Metallen (wie z.B. Magnesuim, Eisen, Zink) entstehen Salze und Wasserstoff.
Bsp.:
- WG: Magnesium + Salzsäurelösung -> Magnesiumchlorid + Wasserstoff
- Eisen + Schwefelsäurelösung -> Eisensulfat + Wasserstoff
7.2 Laugen
Wässrige Lösungen, die Hydroxidionen (OH–– Ionen) enthalten, nennt man Laugen. Sie entstehen beispielsweise, wenn Hydroxide in Wasser gelöst werden.
Wichtige Laugen:

7.3 Indikatoren
Indikatoren zeigen durch ihre Farbe an, ob Lösungen sauer (0<pH<7), alkalisch (7<pH<14) oder neutral (pH=7) sind.
7.4 Neutralisationsreaktion
Die Reaktion einer Säure mit einer Base (Lauge) in entsprechenden Stoffmengen, führt zur Bildung von Wasser und einem Salz. Dabei wird Energie (die sogenannte Neutralisationswärme) frei.
Bsp.:
- WG: Salzsäure + Natronlauge -> Wasser + Natriumchlorid
- Schwefelsäure + Kalilauge -> Wasser + Kaliumsulfat
